Contribuições da Arteriografia Hepática no Tratamento do Câncer de Fígado
Radiol Bras vol.38 no.1 São Paulo Jan./Feb. 2005
doi: 10.1590/S0100-39842005000100003
ARTIGO ORIGINAL
Contribuição da quimioembolização de hepatocarcinomas em pacientes cirróticos na espera pelo transplante hepático*
Contribution of transcatheter arterial chemoembolization of hepatocellular carcinomas in cirrhotic patients awaiting liver transplantation
Luís Francisco LangerI; Adriano Miziara GonzalezII; Jorge Eduardo AmorimIII; Sérgio Aron AjzenIV
IMédico Radiologista, Pós-graduando em Radiologia Clínica e Ciências Radiológicas da Unifesp/EPM
IIMédico Cirurgião Gastroenterologista, Coordenador dos Transplantes do Aparelho Digestivo da Unifesp/EPM
IIIMédico Cirurgião Vascular, Professor Adjunto da Disciplina de Cirurgia Vascular da Unifesp/EPM
IVMédico Radiologista, Livre-Docente, Coordenador do Programa de Pós-Graduação em Radiologia Clínica e Ciências Radiológicas da Unifesp/EPM
Endereço para correspondência
RESUMO
OBJETIVO: Avaliar os resultados da quimioembolização arterial do hepatocarcinoma em pacientes portadores de fígado cirrótico candidatos ao transplante hepático.
MATERIAIS E MÉTODOS: Vinte e três pacientes cirróticos e portadores de hepatocarcinoma, candidatos para o transplante hepático, foram submetidos a múltiplas sessões de quimioembolização hepática com mitomicina C associadamente com lipiodol, avaliando-se prospectivamente: a) níveis séricos de alfa-fetoproteína; b) tamanho tumoral; c) permanência do paciente dentro dos critérios de viabilidade para o transplante hepático; d) grau de disfunção hepática.
RESULTADOS: O nível sérico médio de alfa-fetoproteína sofreu uma redução nos primeiros 13 meses, de 43%. O tamanho médio do tumor no maior eixo, após o seguimento médio de 13,5 meses, foi de 3,2 cm, e de acordo com os critérios da Organização Mundial da Saúde, este tamanho médio mostrou-se como doença estável neste período. O tempo médio de sobrevivência foi de 14 meses.
CONCLUSÃO: O uso pré-transplante da quimioembolização com um esquema terapêutico adequadamente escolhido demonstrou, através do presente ensaio, apresentar poucas complicações e contra-indicações e considerável eficácia antitumoral. Embora a terapêutica adotada tenha aumentado a sobrevida, em comparação a dados históricos de evolução do hepatocarcinoma, este aumento não teve a mesma dimensão que o tempo médio de espera para a realização do transplante, sendo, dessa forma, necessária a associação de outras estratégias para prolongar o tempo de sobrevida ou a redução no tempo de espera do doente.
Unitermos: Hepatocarcinoma; Quimioembolização; Lipiodol.
ABSTRACT
OBJECTIVE: To evaluate the results of hepatocellular carcinoma arterial chemoembolization in cirrhotic patients awaiting liver transplantation.
MATERIALS AND METHODS: Twenty-three cirrhotic patients with hepatocellular carcinoma awaiting liver transplantation were submitted to multiple sessions of chemoembolization using mitomycin C and lipiodol. A prospective evaluation of the following factors was performed: a) serum levels of alpha-fetoprotein; b) tumor size; c) maintenance of the viability criteria for hepatic transplantation; d) degree of liver dysfunction.
RESULTS: The mean serum levels of alpha-fetoprotein were reduced by 43% during the first 13 months. The mean tumor size, as measured by the long axis, after a mean follow-up period of 13.5 months was 3.2 cm, which is considered stable for the period according to the World Health Organization criteria. The mean survival rate was 14 months.
CONCLUSION: In this trial, pre-transplantation use of chemoembolization in combination with an adequately chosen therapy showed few complications and contra-indications as well as a considerable anti-tumor efficacy. Despite the fact that the adopted therapy increased survival rates in comparison to historical evolution data in hepatocellular carcinoma, this increase had not the same dimension if the median waiting time for transplantation is taken into consideration. Therefore, other strategies need to be associated to either make survival rate longer or to reduce transplantation waiting time.
Key words: Hepatocellular carcinoma; Chemoembolization; Lipiodol.
INTRODUÇÃO
Hepatocarcinoma é um tumor que se origina a partir da transformação maligna do hepatócito, caracteristicamente observado como complicação de doença crônica do fígado, ocorrendo quase que exclusivamente na presença de cirrose(1). É uma das principais causas de morte por câncer em todo o mundo, estando entre os dez tumores mais comuns. Embora especialmente comum na África subsaariana, sudeste asiático, Coréia, Japão e Oceania, a incidência em países ocidentais, bastante inferior, tem sofrido importantes elevações devido especialmente ao aumento da incidência de infecção crônica pelo vírus C da hepatite.
No Brasil, o câncer primário de fígado (juntamente com o câncer de vias biliares) ocupava a oitava posição em mortalidade por câncer no ano de 1998, sendo responsável por 4.323 óbitos, passando para a sétima posição em 1999, com 4.682 óbitos(2).
O aparecimento da doença acontece de 20 a 50 anos após o insulto inicial ao hepatócito, e a morte sobrevém, habitualmente, como conseqüência da disfunção hepática, determinando uma sobrevida média de quatro a oito meses após o diagnóstico do tumor, nos pacientes com cirrose associada(3). Como conseqüência a essa extensa disfunção hepática, a melhor opção de tratamento do hepatocarcinoma com tamanho inferior a 5 cm e menos que três nódulos, na presença de cirrose, é o transplante hepático. No entanto, apesar destes progressos evidentes, esbarramos em constantes dificuldades. O diagnóstico se faz geralmente em fase avançada do tumor e o intervalo de tempo até o transplante hepático é longo e superior ao tempo de sobrevida médio.
A quimioembolização hepática é uma técnica intervencionista que pode ser utilizada para o tratamento do hepatocarcinoma, desenvolvida no Japão por Kato et al.(4), consistindo na combinação de infusão intra-arterial (seletiva ou superseletiva) de agentes quimioterápicos com materiais embólicos. O conceito básico é prover altas doses de agentes quimioembólicos ao tecido doente. O efeito terapêutico é baseado em microinfartos associados à ação local prolongada do quimioterápico em função da redução do fluxo sanguíneo no mesmo local. Estudos têm sugerido a capacidade da quimioembolização hepática em controlar os níveis séricos de alfa-fetoproteína (marcador tumoral), o tamanho do tumor e o tempo de sobrevivência do portador do hepatocarcinoma.
Levando-se em consideração o exposto acima, o objetivo do presente estudo foi avaliar a capacidade da quimioembolização arterial hepática do hepatocarcinoma em manter pacientes cirróticos portadores do tumor dentro das condições necessárias durante o tempo de espera para a realização do transplante de fígado.
MATERIAIS E MÉTODOS
Características demográficas
Foram acompanhados, durante um período médio de 13,5 meses (5-25 meses), 23 pacientes com fígado cirrótico, portadores de hepatocarcinoma, em espera para o transplante hepático, submetidos a múltiplas sessões de quimioembolização, com diagnóstico etiológico estabelecido pelo acompanhamento da associação de dados clínicos, epidemiológicos, radiológicos e laboratoriais. Destes pacientes, 20 (87%) eram do sexo masculino e três (13%) eram do sexo feminino. A idade dos integrantes variou entre 43 e 71 anos (média de 59,1 anos).
Os critérios de inclusão foram: existência de lesão tumoral neoplásica primária, confirmada pelo exame de tomografia computadorizada do abdome demonstrando impregnação nodular de contraste oleoso iodado, não maior que 5 cm de diâmetro no maior eixo e não superior ao número de três lesões nodulares.
No presente estudo, a média do maior diâmetro do maior nódulo tumoral (em caso de múltiplos), ao início do estudo, foi de 2,9 cm, variando entre 1,2 e 5,0 cm, e o número de pacientes com múltiplos nódulos foi de 11 (48%) contra 12 (52%) pacientes com nódulo único. Sendo os pacientes candidatos ao transplante hepático, deviam ainda estar livres de metástases tumorais extra-hepáticas, descartadas pelos exames de cintilografia óssea, radiografia do tórax, tomografia computadorizada de crânio e a própria tomografia computadorizada do abdome. A disfunção hepática não foi critério de exclusão, participando do estudo pacientes com disfunção hepática inicial grau Child A (16; 70%), Child B (5; 21%) e Child C (2; 9%). Nenhum paciente incluído na proposta de tratamento havia sido previamente tratado por outro método terapêutico.
As características demográficas e a etiologia da hepatopatia de base da população incluída no estudo estão demonstradas na Tabela 1.
Procedimento experimental
As sessões de quimioembolização foram realizadas dentro do setor de Radiologia Vascular e Intervencionista do Hospital São Paulo - Universidade Federal de São Paulo/Escola Paulista de Medicina (Unifesp/EPM), pela cateterização seletiva da artéria hepática própria, ou artéria hepática direita, ou artéria hepática esquerda, via punção da artéria femoral comum direita ou esquerda (técnica de Seldinger), usando-se cateter 5 French (usualmente tipo Cobra visceral). Nos pacientes incluídos não foi necessário, em nenhum momento, o acesso via artérias radial, braquial ou axilar. Também foi realizada no primeiro procedimento, injeção seletiva de contraste iodado hidrossolúvel através da artéria mesentérica superior para realização de portografia, com fins de elaboração da melhor conduta cirúrgica no transplante.
A confirmação da patência ou não da veia porta não alterou o esquema terapêutico adotado para a quimioembolização. As drogas utilizadas para o esquema terapêutico propriamente dito foram exclusivamente a mitomicina C (como agente quimioterápico) (Kyowa Hakko Kogyo, Tóquio, Japão) associada ao lipiodol (contraste oleoso como agente embolizante) (Andre Guerbet, Aulnay sous Bois, França) na dosagem de 10 mg e 10 ml, respectivamente, misturadas mediante bombeamento entre seringas descartáveis até a homogeneização total dos fármacos, realizado imediatamente antes da utilização. Para melhorar a fluidez e diminuir a viscosidade da solução, foram adicionados 5 a 10 ml de contraste iodado hidrossolúvel, facilitando desta forma a infusão das drogas. A injeção da mistura quimioembólica foi realizada no ramo lobar correspondente à demonstração da lesão, até a infusão total da dose ou até a cessação completa do fluxo arterial, para que não houvesse refluxo através da artéria gastroduodenal.
A principal contra-indicação ao procedimento terapêutico foi a história prévia de reação moderada a grave, com o uso do meio de contraste iodado. Entretanto, nenhum dos pacientes selecionados apresentava essa contra-indicação.
Após cada intervenção terapêutica, os pacientes recebiam alta após oito horas de repouso no leito desde que na ausência de intercorrências.
Variáveis e método estatístico
As variáveis consideradas inicialmente foram: a) níveis séricos de alfa-fetoproteína; b) tamanho do tumor e surgimento de novos nódulos tumorais; c) tempo de permanência do paciente dentro dos critérios de viabilidade para o transplante hepático; d) grau de disfunção hepática.
As sessões de quimioembolização foram programadas para a repetição a cada 90 dias, sempre que as condições clínicas do paciente permitissem, até a realização do transplante. No total foram realizadas 74 sessões, variando de uma a sete sessões por paciente (média de 3,2 sessões por paciente). O tempo entre a data estabelecida como momento do diagnóstico e o início do tratamento proposto foi de aproximadamente um mês.
Três semanas após a realização de cada sessão, o paciente era submetido à tomografia computadorizada do abdome para o acompanhamento da resposta do tumor com base em suas dimensões (tamanho tumoral). Esta resposta radiológica ao esquema instituído foi definida de acordo com critérios da Organização Mundial da Saúde (OMS): remissão completa (RC) - ausência de lesão tumoral remanescente, sem o surgimento de novos tumores; remissão parcial (RP) - diminuição do tamanho tumoral em no mínimo 50% constatada em dois exames subseqüentes com intervalo superior a quatro semanas, sem o surgimento de novas lesões; doença estável (DE) — diminuição do tamanho tumoral inferior a 50% ou aumento não superior a 25%, sem o surgimento de novos tumores; progressão da doença (PD) — aumento do tamanho do tumor superior a 25% ou surgimento de novas lesões. A mensuração dos nódulos sempre foi feita considerando-se o maior eixo da lesão em todos os sentidos.
Perda do controle da doença, ou perda da viabilidade para o transplante hepático, caracterizada pelo aumento das dimensões do tumor além do tamanho máximo para a realização do transplante, surgimento do quarto ou mais tumores, surgimento de metástases, ou morte do paciente por evolução da doença, foi definida como tempo de sobrevivência. A análise estatística foi feita com programa SPSS for Windows® e a análise da tabela de sobrevivência foi efetuada pelo método de Kaplan-Meier, permitindo o delineamento gráfico.
RESULTADOS
Marcador tumoral
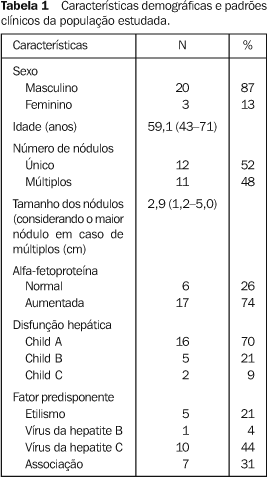
Os níveis séricos de alfa-fetoproteína variaram desde o início entre os pacientes estudados. Seis destes pacientes apresentavam níveis normais do marcador tumoral. Entretanto, a média dos níveis do grupo sofreu redução máxima nos primeiros 13 meses (43% em comparação com o nível prévio ao início do tratamento, o qual foi de 168 ng/ml). Os níveis do marcador tumoral só ultrapassaram os níveis iniciais após o período compreendido entre o 13º e o 16º mês, momento a partir do qual a elevação foi acentuada, ultrapassando níveis duas vezes acima do inicial, 19 meses após o diagnóstico (Figura 1).
Dos 17 pacientes com níveis iniciais aumentados, cinco tiveram seus níveis séricos de alfa-fetoproteína retornados a níveis normais em alguma fase do tratamento.
Tamanho do tumor e surgimento de novos nódulos tumorais
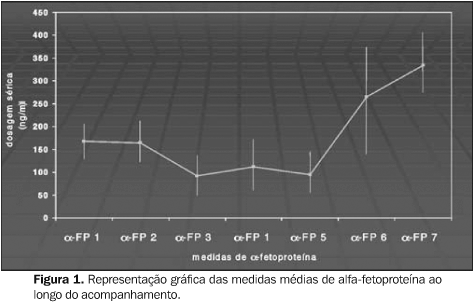
O tamanho tumoral médio do grupo, previamente ao início da aplicação do protocolo, foi de 2,9 cm de diâmetro no maior eixo (variando de 1,2 a 5 cm). Após o intervalo de 13,5 meses (seguimento médio), o tamanho médio do tumor no maior eixo foi de 3,2 cm (Figura 2).
Na análise individual, ao término do período de acompanhamento, dois pacientes obtiveram, com o tratamento, regressão total do tumor. Outros dois pacientes apresentaram regressão parcial. Oito pacientes apresentaram progressão da doença. Os demais mostraram estabilidade da doença. Com relação ao surgimento de novos tumores, que ocorreu em cinco pacientes, em média aos 11 meses após o diagnóstico, quatro foram em tempo inferior a 14 meses e somente um paciente demonstrou o surgimento além deste tempo. O primeiro novo nódulo tumoral surgiu aos cinco meses de acompanhamento.
Sobrevivência
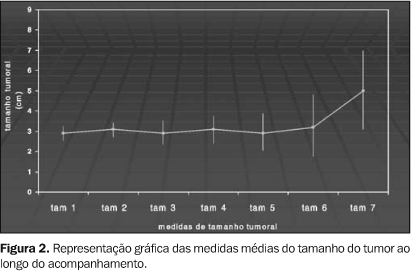
Ao final do estudo, dos 23 pacientes, 11 (48%) permaneciam vivos, sendo que, destes, oito foram submetidos ao transplante de fígado ortotópico e três continuavam em tratamento e à espera do transplante. Sete pacientes perderam os critérios preestabelecidos para a realização do transplante (devido a progressão do tumor ou descompensação da função hepática, culminando em óbito). Os demais pacientes (cinco) evoluíram para óbito, de causa não relacionada à evolução do tumor ou a conseqüente disfunção hepática, ou recusaram a continuação do tratamento (perda não relacionada) (Figura 3).

O tempo médio de sobrevivência foi de 14 meses, com sobrevivência em seis meses, um ano, um ano e seis meses e dois anos, de 100%, 74,2%, 37,1% e 37,1%, respectivamente. A curva de sobrevivência dos 23 pacientes é mostrada na Figura 4.
Segurança e tolerância
Não houve mortalidade relacionada ao procedimento. Dos 23 pacientes acompanhados, menos de 27% apresentaram sintomas de náusea e dor abdominal, facilmente controláveis com tratamento medicamentoso sintomático como analgésicos e antieméticos. Esses efeitos colaterais foram referidos durante e logo após o término do procedimento e não foram considerados como complicações, mas sim como sinais de síndrome pós-quimioembolização. Somente dois pacientes apresentaram insuficiência renal, o que determinou a internação prolongada, com reversão completa do quadro nos dias subseqüentes.
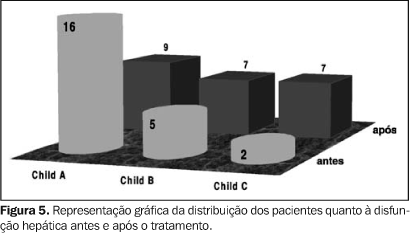
Houve piora significativa da função hepática ao longo do acompanhamento, com aumento do número de pacientes na classificação Child-Pugh classe C e diminuição do número de pacientes com disfunção leve (Child-Pugh classe A). Aplicando-se o teste de homogeneidade marginal aos dados relacionados a essa seção, obteve-se nível descritivo de 0,001 (p < 0,001) (Figura 5).
DISCUSSÃO
O tratamento do hepatocarcinoma tem sido um problema de difícil solução, pois o prognóstico depende tanto da extensão tumoral quanto da reserva funcional do órgão. Entretanto, recentes estudos têm contribuído com novas formas de tratamento do hepatocarcinoma. Uma destas formas é o transplante ortotópico de fígado, capaz de tratar não só o tumor como da hepatopatia de base: o fígado cirrótico. Sendo assim, pacientes com fígado cirrótico, portadores de hepatocarcinomas menores que 5 cm e com até três lesões, são candidatos à realização do transplante de fígado. Porém, no nosso meio, onde o número de doadores tem sido insuficiente, o tempo de espera do receptor está na maioria das vezes além do tempo de evolução da doença (sobrevida média de quatro a oito meses após o diagnóstico do tumor, nos pacientes com cirrose associada(3)). A associação de um método terapêutico visando a desacelerar esta evolução do hepatocarcinoma, permitindo a manutenção das condições necessárias ao transplante para o portador do hepatocarcinoma, é uma alternativa viável.
Por outro lado, não existe um estudo prospectivo randomizado, nem um consenso para o melhor protocolo de quimioembolização pré-transplante hepático, pois o tempo de espera, a priorização, a forma de tratamento e outros fatores variam com o serviço. Desta forma, diversos esquemas terapêuticos estão disponíveis para o tratamento do hepatocarcinoma.
Optamos pelo uso da quimioembolização hepática nestes pacientes, já que alguns estudos têm sugerido que a quimioembolização pode ser útil no tratamento do hepatocarcinoma em pacientes cirróticos não candidatos a ressecção cirúrgica ou ablação percutânea, limitando o desenvolvimento do tumor durante o tempo de espera pelo transplante ortotópico de fígado(5).
A eficácia, entretanto, da terapêutica quimioembólica do hepatocarcinoma provavelmente varia conforme o estágio do tumor no início do tratamento, a reserva funcional do fígado e o esquema terapêutico adotado(6).
Assim sendo, dentre os diferentes esquemas quimioembólicos, foi necessária a seleção de um que trouxesse complicações de gravidade relativamente menor, uma vez que foram incluídos pacientes com grau de disfunção hepática Child A, B e C. Com este cuidado, utilizamos exclusivamente mitomicina C como agente quimioterápico e lipiodol como agente embólico, não fazendo o uso associado de esponja de gelatina ou outro material embolizante. A maioria dos autores utiliza outras drogas quimioterápicas (cisplatina, adramicina, doxorrubicina) em vez da mitomicina C, ou associação desta com outras, as quais parecem ser mais efetivas(7). Por outro lado, o uso destas drogas que não a mitomicina C, dada a maior toxicidade, tem trazido complicações em índices mais elevados, o que só foi observado no presente estudo em dois pacientes, perfazendo menos de 10%. Este índice foi semelhante ao de outros estudos(7) que utilizaram também esquemas terapêuticos menos agressivos. Taxas de mortalidade substancialmente elevadas (superiores a 7,4%) também foram observadas com o uso de outros agentes quimioterápicos, em detrimento à mitomicina C(7). Na população estudada por nós, nenhuma morte ocorreu nos 30 dias subseqüentes ao procedimento, e as complicações observadas (dois casos) foram de gravidade moderada e reversíveis.
Agentes embolizantes como esponja de gelatina e polivinil-álcool (PVA) também têm sido largamente empregados por inúmeros autores no esquema terapêutico quimioembólico do hepatocarcinoma. Embora se observem relatos de ação mais eficaz sobre o tumor com a associação de uma destas substâncias, há também complicações mais graves e aumento nas taxas de mortalidade, especialmente ocasionado pelos pacientes com função hepática mais pobre(7-9). Lembrando que na população estudada incluímos pacientes com disfunção hepática importante (Child C) ou com trombose de veia porta, o uso de esponja de gelatina ou PVA foi totalmente contra-indicado, o que, ao contrário, possivelmente acarretaria complicações graves e até mesmo fatais.
Devido à alta variação anatômica do suprimento arterial do fígado, foi necessária a realização prévia da arteriografia hepática à quimioembolização, com fins de avaliação e planejamento da cateterização seletiva dos vasos em questão, visando também a evitar a quimioembolização inadvertida da artéria gastroduodenal, o que levaria a complicações graves e síndrome pós-embolização grave(10). Portografia também foi realizada na primeira sessão. Entretanto, a confirmação da patência ou não da veia porta não alterou o planejamento inicial, uma vez que não foram utilizados esponja de gelatina ou PVA como agentes embolizantes. O não uso da esponja de gelatina também teve como propósito evitar a exclusão de pacientes que pudessem apresentar trombose da veia porta.
O protocolo aplicado previu a repetição das sessões de quimioembolização a cada três meses. Porém, nem todos os pacientes puderam obedecer a esta regra. O fator determinante foi a condição clínica de cada paciente necessária para a realização do procedimento, a qual nem sempre foi a esperada. Desta forma, o número de procedimentos por paciente e o tempo entre cada sessão sofreram variações.
Com relação à confirmação diagnóstica do hepatocarcinoma, a biópsia nem sempre é recomendável ou exeqüível. Presença de implante tumoral no trajeto da biópsia é um acontecimento que varia de 0,1% até 2%, ocorrendo tanto no próprio órgão que aloja o tumor quanto em estruturas vizinhas, como parede abdominal e diafragma(11,12). Segundo relatam Navarro et al., riscos de implante são subestimados e não podem ser negligenciados, afirmando ainda que pequenos tumores sugestivos de hepatocarcinoma, passíveis de ressecção ou em candidatos ao transplante, não devem ser puncionados(11). Além disso, os pacientes cirróticos normalmente são portadores de coagulopatias, ascite, necessitando de transfusões prévias, tornando-os mais suscetíveis a complicações, já conhecidas pelo procedimento. Os nódulos, por vezes, encontram-se em posição de difícil acesso e em número maior do que um, necessitando de múltiplas biópsias, as quais também nem sempre obtêm material adequado para a comprovação histológica. No estudo de Caturelli et al., metade dos 14 pacientes (diagnosticados como portadores de hepatocarcinoma) submetidos à biópsia por agulha fina guiada por ultra-som não apresentou elementos neoplásicos, e em um outro grupo de 23 pacientes, somente em seis pacientes foi possível a confirmação histológica(13), devido à presença de material necrótico. Na Unifesp/EPM, Forones et al., em 1994, relataram uma associação dos hepatocarcinomas diagnosticados com aumento de alfa-fetoproteína em 92% dos casos(14). Concentrações séricas de alfa-fetoproteína são normalmente inferiores a 20 ng/ml, em adultos saudáveis. Em 1996, Zoli et al. avaliaram 34 pacientes com hepatocarcinoma e concluíram que alfa-fetoproteína maior que 200 ng/ml apresenta alta especificidade(15). Em 1994, Pateron et al. avaliaram 322 pacientes com cirrose, prospectivamente, por dois anos, concluindo que a ultra-sonografia apresenta especificidade de 90% e que a alfa-fetoproteína maior que 15 ng/ml e 100 ng/ml apresenta especificidade de 86% e 93%, respectivamente(16). Esses dados, acrescidos de outros exames que se seguem na investigação e tratamento, como tomografia computadorizada e arteriografia (alta sensibilidade e alta especificidade)(17,18), levaram-nos a descartar o uso da biópsia hepática e a considerar dados clínicos, epidemiológicos, radiológicos e laboratoriais.
Comprovações futuras dos resultados encontrados em nosso estudo serão mais bem realizadas através de ensaios randomizados. Infelizmente, um ensaio deste modo não foi passível de execução no presente momento, dadas as dificuldades e implicações éticas no uso de grupos controles que não receberiam nenhum tipo de tratamento. Além disso, a comparação entre diferentes métodos de tratamento nem sempre é possível em função da grande diversidade de características que cada paciente apresenta.
Assim, o tratamento do hepatocarcinoma tem sido um problema de difícil solução, pois o prognóstico depende tanto da extensão tumoral quanto da reserva funcional do órgão. Entretanto, recentes estudos têm contribuído com novas formas de tratamento do hepatocarcinoma. Uma dessas formas é o transplante ortotópico de fígado. Porém, no nosso meio, onde o número de doadores tem sido insuficiente, o tempo de espera do receptor está na maioria das vezes além do tempo de evolução natural da doença. A associação de um método terapêutico visando a desacelerar esta evolução do hepatocarcinoma, permitindo a manutenção das condições necessárias ao transplante para o portador do hepatocarcinoma, é uma alternativa viável. Com este propósito, o uso pré-transplante da quimioembolização com um esquema terapêutico adequadamente escolhido demonstrou, através do presente ensaio, apresentar poucas complicações e contra-indicações e de considerável eficácia antitumoral, conclusões estas obtidas quando se observa que tanto os níveis séricos do marcador tumoral como o tamanho do nódulo sofreram redução ou mantiveram-se estáveis dentro de um período médio de 14 meses. Embora a terapêutica adotada tenha aumentado a sobrevida, em comparação a dados históricos de evolução do hepatocarcinoma, este aumento não teve a mesma dimensão que o tempo médio de espera para a realização do transplante, sendo, desta forma, necessária a associação de outras estratégias para prolongar o tempo de sobrevida ou a redução no tempo de espera do doente.
REFERÊNCIAS
1. Trinchet JC, Ganne-Carrie N, Beaugrand M. Intra-arterial chemoembolization in patients with hepatocellular carcinoma. Hepatogastroenterology 1998;45 Suppl 3:1242-7.
2. Instituto Nacional de Câncer. Disponível em URL: www.inca.org.br/cancer/figado. Acessado em junho/2002.
3. Stuart KE, Ribas A, Talavera F, Kahn MJ, McKenna R, Macdonald JS. Hepatic carcinoma, primary. eMedicine Journal 2002;3. Disponível em URL: www.emedicine.com. Acessado em março/2002.
4. Kato T, Nemoto R, Mori H, Takahashi M, Tamakawa Y, Harada M. Arterial chemoembolization with microencapsulated anticancer drug. An approach to selective cancer chemotherapy with sustained effects. JAMA 1981;245:1123-7.
5. Roumilhac D, Sergent G, Pruvot FR, et al. Treatment of hepatocellular carcinoma: pathologic results after chemoembolization and liver transplantation. Transplant Proc 1999;31:416-7.
6. Ernst O, Sergent G, Mizrahi D, Delemazure O, Paris JC, L'Herminé C. Treatment of hepatocellular carcinoma by transcatheter arterial chemoembolization: comparison of planned periodic chemoembolization and chemoembolization based on tumor response. AJR 1999;172:59-64.
7. Achenbach T, Seifert JK, Pitton MB, Schunk K, Junginger T. Chemoembolization for primary liver cancer. Eur J Surg Oncol 2002;28:37-41.
8. Cai-de L, Yi-geng Q, Shu-you P. Lipiodolization with or without gelatin sponge in hepatic arterial chemoembolization for hepatocellular carcinoma. Chinese Med J 1994;107:209-15.
9. Suzuki M, Suzuki H, Yamamoto T, et al. Indication of chemoembolization therapy without gelatin sponge for hepatocellular carcinoma. Semin Oncol 1997;24(2 Suppl 6):110-5.
10. Dawson S, Ray JRC, Geller S. Hepatic chemoembolization and percutaneous ablation. In: Taveras JM, Ferruci JT, eds. Radiology, diagnosis - imaging - intervention. Philadelphia, PA: Lippincott-Raven, 1996:2(137A):1-13.
11. Navarro F, Taourel P, Michel J, et al. Diaphragmatic and subcutaneous seeding of hepatocellular carcinoma following fine-needle aspiration biopsy. Liver 1998;18:251-4.
12. Liu C, Frilling A, Dereskewitz C, Broelsch CE. Tumor seeding after fine needle aspiration biopsy and percutaneous radiofrequency thermal ablation of hepatocellular carcinoma. Dig Surg 2003;20: 460-3.
13. Caturelli E, Biasini E, Bartolucci F, et al. Diagnosis of hepatocellular carcinoma complicating liver cirrhosis: utility of repeat ultrasound-guided biopsy after unsuccessful first sampling. Cardiovasc Intervent Radiol 2002;25:295-9.
14. Forones NM, Queiroz LAGP, Blum VF, et al. Hepatocarcinoma: análise de 14 casos. Rev Ass Med Brasil 1994;40:300-2.
15. Zoli M, Magalotti D, Bianchi G, Gueli C, Marchesini G, Pisi E. Efficacy of a surveillance program for early detection of hepatocellular carcinoma. Cancer 1996;78:977-85.
16. Pateron D, Ganne N, Trinchet JC, et al. Prospective study of screening for hepatocellular carcinoma in caucasian patients with cirrhosis. J Hepatol 1994; 20:65-71.
17. Ikeda K, Saitoh S, Koida I, et al. Diagnosis and follow-up of small hepatocellular carcinoma with selective intraarterial digital subtraction angiography. Hepatology 1993;17:1003-7.
18. Hwang GJ, Kim MJ, Yoo HS, Lee JT. Nodular hepatocellular carcinomas: detection with arterial-, portal-, and delayed-phase images at spiral CT. Radiology 1997;202:383-8.
Endereço para correspondência
Dr. Luís Francisco Langer
Rua Quinze de Novembro, 405, Centro
Passo Fundo, RS, 99010-090
E-mail: langerlf@ibest.com.br
Recebido para publicação em 10/2/2004. Aceito, após revisão, em 5/4/2004.
*Trabalho realizado no Setor de Radiologia Vascular e Intervencionista do Hospital São Paulo - Universidade Federal de São Paulo/Escola Paulista de Medicina (Unifesp/EPM), São Paulo, SP.




 Twitter
Twitter
 Facebook
Facebook
 Instagram
Instagram
 LinkedIn
LinkedIn
